
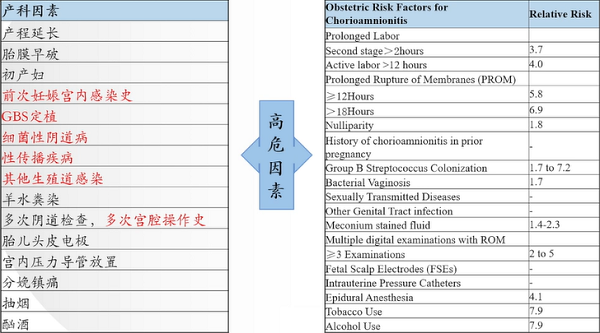
宫内感染的高危因素
宫内感染病常见原体
细菌:B族链球菌、大肠杆菌是宫内感染最常见的厌氧菌;
支原体:解脲支原体是下生殖道常见寄生菌 (>70%);
衣原体:沙眼衣原体引起泌尿生殖道感染已成为最常见的性传播疾病;
其他:TORCH、微小病毒B-19、真菌和原虫。
一项入组298例死胎的研究显示:其中179个胎盘组织中培养出可能与死胎相关的细菌,最常见的细菌有大肠杆菌、粪肠球菌和B族链球菌。
病原体
一般是多种微生物感染,常涉及阴道或肠道菌群;
2/3的患者羊水标本中至少有2种分离株;
母亲血液循环的病原体经胎盘感染更可能为单一病原体感染,例如:李斯特菌、金葡萄。
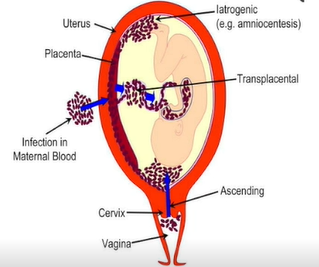
宫内感染途径
上行性感染:通过阴道和宫颈(最主要途径)
血行途径:通过胎盘进入
逆行种植:腹腔内感染通过输卵管(阑尾炎)
介入性操作:羊膜腔操作、脐带穿刺等
宫内感染的严重程度
宫内感染的严重程度取决于病原体的数量和毒力、胎盘免疫状态、母体的免疫状态和胎儿成熟度。
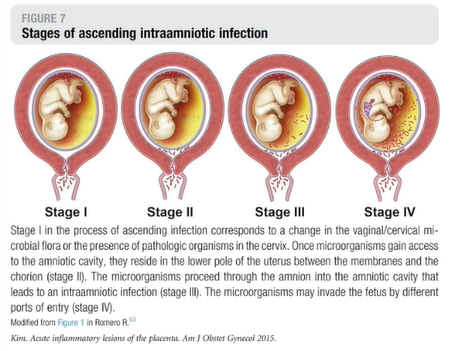
上行性感染分期
I期:阴道和宫颈微生物群的改变,或宫颈内存在病原微生物;
II期:致病菌进入宫腔在蜕膜组织中定位→蜕膜炎或绒毛膜炎;
III期:侵入胎儿血循环(绒毛膜脉管炎),也可能穿透羊膜,引起羊膜炎;
IV期:进入羊膜腔感染胎儿。
宫内感染机制
宫内感染可激活母体和胎儿的免疫炎症应答系统。大量的炎性细胞因子,如IL-6、IL-8、TNF-α等,可导致母体胎膜早破、宫颈软化、诱导子宫收缩,导致胎儿大脑软化等。为此,一旦发现宫内感染,应及时进行干预。
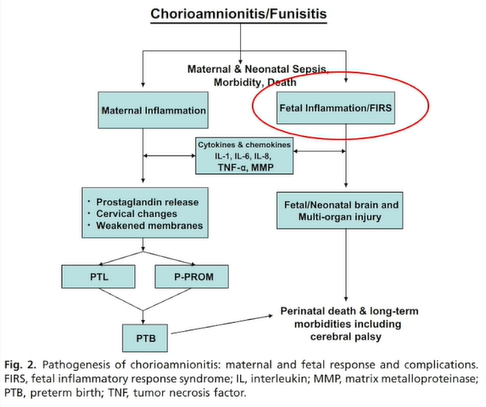
胎儿炎性反应综合征(FIRS)
当胎儿暴露于细菌、病毒、真菌及寄生虫,或受到非感染相关刺激时,胎儿发生的全身炎症反应。
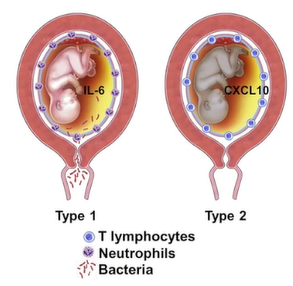
TIRS Type1:在羊膜内感染的情况下,胎儿全身炎症会导致胎儿血浆中细胞因子IL-6的升高,组织学特征是脐带炎和绒毛膜血管炎;
TIRS Type2:与母体和胎儿间的免疫排斥反应相关,胎儿血浆CXCL10浓度升高;可累及胎儿全身各个器官,造成损伤。
FIRS可导致什么不良结局?
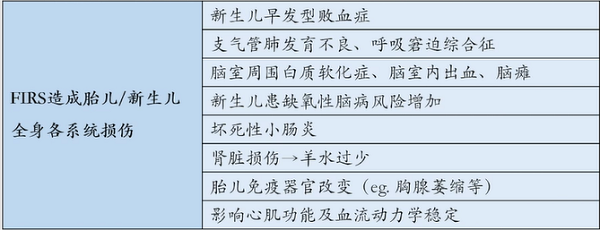
FIRS造成胎儿全身各系统损伤,不良妊娠结局增加。
临床宫内感染的诊断
非特异性临床表现及敏感度如下:
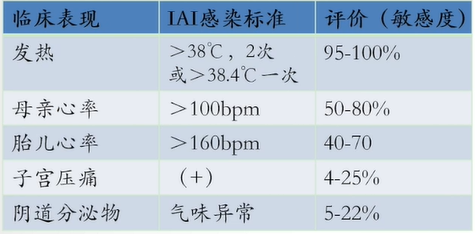
宫内感染可以是亚临床,不具有上述临床表现;
亚临床感染可表现为胎膜未破的早产临床或PPROM。
如何早期发现宫内感染?
目前临床检测指标:
血清学:血常规,C-反应蛋白,降钙素原,TORCH;
培养:血培养、阴道分泌物培养、羊水培养;
病理:胎盘组织。
通过羊膜腔穿刺获得的羊水检测可靠性高,是宫内感染的金标准,但为侵入性操作,患者依从性差。羊水细菌培养结果很难在三天内获得,且革兰色染色分析假阴性率高,因此羊水中炎性介质的检查被认为更有意义。羊水中的中性粒细胞主要来自胎儿,因此又以羊水白细胞计数更具参考价值。
Mirjam Kunze等研究表明,羊水IL-6和TNF-α是FIRS和严重新生儿发病率的强烈预测因子;
Ohkuma Kana等研究提出,单独使用羊水IL-6可用于产前诊断FIRS,需进一步验证,但可能通过保持羊水IL-6低于临界值来治疗IAI,同时防止对中枢神经和呼吸系统的损害。
宫内感染诊断——IL-6
脐带炎和绒毛膜血管炎是FIRS的组织学特征,根据胎儿血浆IL-6浓度可以预测宫内感染值。
脐带中IL-6的cut-off值为:11 pg/ml,羊水中IL-6、TNF-α可作为FIRS的预测因子,cut-off值分别为1000 pg/ml、200 pg/ml。
宫内感染诊断——羊水取样
羊膜腔穿刺是宫内诊断的金标准,但是存在侵入性、无法重复取样等缺点。
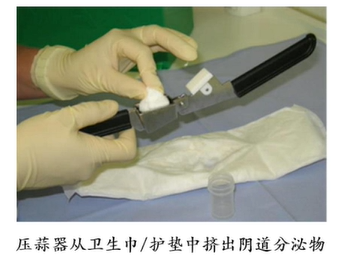
对于胎膜早破的患者,有研究中提到一种无创的羊水采样方法,可重复进行。即利用压蒜器从卫生巾/护垫中挤出阴道分泌物进行检查IL-6和TNF-α的检测。
PPROM阴道分泌物中的IL-6和TNF-α的早期预测可以改善FIRS和不良新生儿的结局。
宫内感染——非特异性超声异常
产前诊断进行超声检测如遇到以下情况,需考虑宫内感染:FGR、侧脑室增宽甚至脑积水、颅内钙化灶、小头畸形、心脏畸形、水肿、胎盘增厚、肝脾肿大、肠管回声增强、羊水量及性状异常、多勒普血流异常等。
宫内感染——胎盘及脐带病理检查
胎盘:Pettker等研究:组织学检测对于腹腔感染(IAI)的诊断敏感性较高 (80%~100%),但特异性较低(23%~52%) ,在用于预测患者是否为IAI时应该结合羊水培养的结果;
组织学检查结果并不完全与IAI结果一致,Smulian等研究结果显示,临床诊断为IAI的患者中仅有62%有病理结果支持,其他可能是由麻醉后发热及胎膜早破导致的误诊,对于怀疑为IAI的患者来说,即使羊水培养结果为阴性,病理检查同样是必要的;
Holcroft等研究显示,对IAI的患者进行病理检查中,脐带炎的诊断更有利于评估炎症对新生儿的影响,几乎所有的脐带炎病例均合并有宫内感染诊断,但仅有60%的宫内感染病例合并有脐带炎。
宫内感染治疗
解脲支原体是从临床绒毛膜羊膜炎患者的羊水中分离出的最常见微生物。随机对照试验使用的抗生素并未提供针对解脲支原体和支原体的覆盖范围,那么如何更好地使用抗生素?
抗生素的选择
抗生素通过胎盘,到达宫内环境的浓度足以治疗或预防感染。要求抗生素针对已知宫内感染相关的微生物有效,并且容易获取,无致畸性,无耐药性。
抗生素胎盘转移
不完全转移:脐血浓度低于母血浓度;
完全转移:母血和脐血中达到平衡;
超转移:脐血浓度高于母血浓度;
头孢曲松可提高需氧菌的覆盖率,克拉霉素的胎盘传代率远远高于红霉素或阿奇霉素,其对解脲支原体和支原体发挥作用,甲硝唑具有最佳厌氧菌覆盖率。
联合抗生素可以延长抗生素到分娩的中位数间隔,降低急性组织学绒毛膜羊膜炎和脐带炎发生率,降低新生儿脑室出血和脑瘫发生率,改善了宫内感染孕妇的围生儿结局,但在没有宫内感染孕妇中没有改善。因此,联合抗生素治疗宫内感染可以改善未足月胎膜早破、宫内感染患者的围产结局。
产科脓毒症
脓毒症是宿主对感染反应失调导致危及生命的器官功能障碍,妊娠本身即是脓毒症的危险因素,脓毒血症导致的孕产妇死亡率高,强调防治宫内感染相关的产科脓毒血症,一旦怀疑或诊断脓毒血症需早期识别,初期处理,降低相关不良结局。指南推荐:
不管是否存在发热,在感染的基础上出现不明原因的终末器官损害,应考虑脓毒症诊断;
任何怀疑脓毒症的孕妇,应在1小时内开始经验性广谱抗生素治疗;
一旦怀疑或诊断脓毒症,就应尽快获取培养物(血、尿、痰培养等) 送检并测定血清乳酸水平,尽早实现源头控制;
脓毒症并发低血压或器官低灌注时,应尽快给予晶体液1 L~2 L。
产时发热临床处理流程
当孕产妇出现发热,怀疑宫内感染时,需重视产时发热的规范管理。
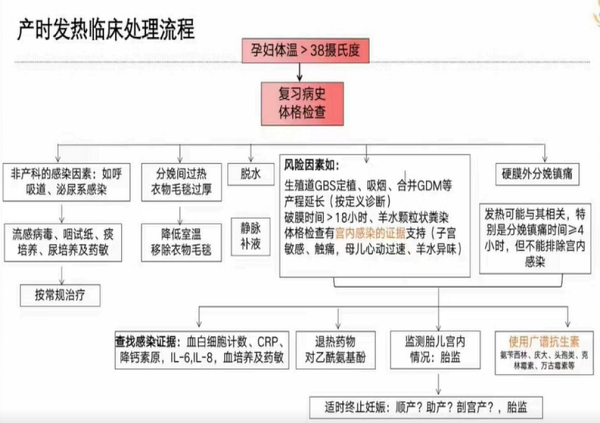
(产时发热临床处理流程)







 2020
2020 