关键信息
■ 根据国家药监局《定性检测体外诊断试剂分析性能评估注册审查指导原则》,基于量值检测后通过阈值判断结果的检测试剂为定性试剂。
■ 关于HPV定量可以作为CIN2+的临床截断值,并不是“HPV定量”的最新研究发现,本质上这个概念,就是HPV定性检测一直以来所强调的临床cut-off值。
■ 美国FDA关于HPV病毒载量的说明,并不是支持HPV定量的临床价值,而是强调HPV定性检测中的临床cut-off值的价值。
要回答这个问题,首先需要明确,在体外诊断(IVD),定量检测和定性检测试剂的区别,2022年国家药监局医疗器械技术审评中心先后发布了《定量检测体外诊断试剂分析性能评估注册审查指导原则》[1](以下简称《定量试剂指导原则》)和《定性检测体外诊断试剂分析性能评估注册审查指导原则》[2](以下简称《定性试剂指导原则》),这两个文件给出了非常明确的定义:
《定量试剂指导原则》:定量检测体外诊断试剂是指“可测量分析物(analyte)的量或浓度并以适当单位的数字量值表达结果的试剂”。
定量试剂的量值应该溯源到公认的参考品、标准品。在应用方面,定量结果可以用于动态观察治疗效果,判断病情的演变,比如血糖定量检测,可以监测不同时间段血糖量值的变化,提示治疗的效果。
《定性试剂指导原则》:定性检测试剂是“无量值报告的检测试剂和基于量值检测后通过阈值判断结果的检测试剂”。
定性检测会设定阳性判断值(cut-off值),“作为判断特定疾病、状态或被测物存在或不存在的界限的量值”,“高于此阈值的结果报告为阳性,而低于此阈值的结果报告为阴性”。可以明确:定性试剂也是基于量值来设定cut-off值,并不能因此就把这个检测定义为定量检测。比如新冠PCR检测,以CT值35作为判断阴/阳性的cut-off值,但新冠检测是定性检测,而非定量检测。
关于HPV检测,没有研究证明,病毒载量值可以用于疾病的动态监控,国际上主流的指南和监管机构,都明确目前临床用于宫颈癌筛查的,都是HPV定性检测。HPV的感染,绝大多数都是一过性感染,所以设定以临床CIN2+的病毒载量值作为阴阳性判读的cut-off值尤为重要,FDA批准的HPV检测,都具有临床cut-off值。其中PCR技术的HPV检测试剂,都会设定一个以病毒载量为基础的CT值,作为为报告阴性和阳性的cut-off,以cobas HPV为例,该检测以CIN2+临床敏感性≥90%为目标,通过29,000研究对象的筛查和病理结果,选择特定CT值作为临床cut-off值[3]。
所谓美国FDA支持HPV定量,是对FDA观点的误解。
2019年3月,美国FDA发布了关于《New Approaches in the Evaluation for High-Risk Human Papillomavirus Nucleic Acid Detection Devices》[4],其中提到“HPV病毒载量是和宫颈癌前病变相关的主要因素,尤其是A9亚组”,同时后半句也强调了“因此高危型HPV检测应该设置一个临床cut-off,只有超过那个阈值的才应该被报告为阳性,以此减少对那些一过性感染的检出”FDA另外又强调,“目前没有被普遍接受的HPV定量的国际标准品”(这一点也说明,HPV“定量”检测并不符合国家药监局《定量指导原则》关于定量试剂参考物质要求“具有互换性的有证参考物质,公认的参考品、标准品”,难以注册获批)。
由此,如果完整的去看FDA的这个文件,不难发现,FDA提到的病毒载量,只是为了强调设定临床cut-off值的必要性,这是HPV定性检测所必须的,并非支持HPV定量的临床应用。

一些研究认为HPV载量和病变的严重程度不相关,为什么可以HSIL的病毒载量值来设定临床cut-off值?
2017年美国国立卫生研究院(NIH)关于病毒整合的综述中说明[5],HPV病毒核酸的大量复制,是发生在基底层细胞的分化阶段,而随着病毒发生整合,病毒生命周期终结。这说明可能在整合发生较少的早期阶段,HPV的载量对于设定针对CIN2的cut-off值有一定的价值,但是对于更高级别的CIN3以及癌症,病毒载量难以区分,很多研究结果显示在癌症中,病毒载量反而是下降的。
以下图HPV16型在不同级别宫颈病变病毒载量的箱线图为例[6],以HSIL的病毒载量下限(红色圈)作为临床cut-off值进行截断,病毒载量低于cut-off,报告阴性,从而减少了对一部分NILM和LSIL的HPV感染的检出(绿色框)。
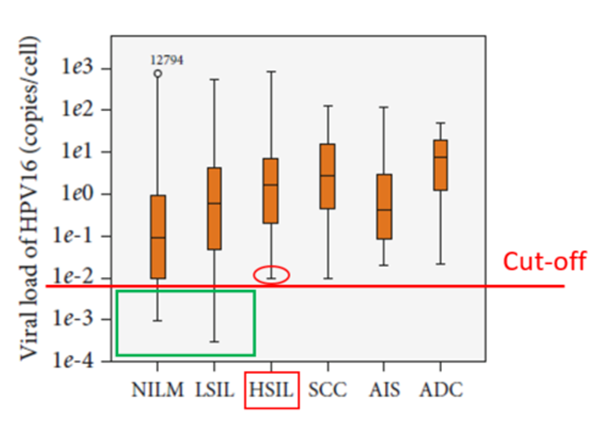
在Pubmed中输入“HPV viral load”搜索,关于HPV定量的研究,最早可以追溯到1991年,30年过去了,HPV定量的研究很多,但能否应用于临床始终充满了争议。归纳起来,争议主要集中在几个方面:
1.从生物学机制方面,HPV病毒复制主要来源于低级别病变,而在发生大量病毒整合的高级别病变中,病毒复制能力显著降低。
2.Mark Schiffman 2017年发表研究,虽然A9组的定量平均值(Mean)升高和病变之间具有统计学关系,但在“有和没有 CIN2/3 的女性之间的病毒定量范围,有很大的重叠,结果并不能证明,改变目前临床使用的 HPV 定性检测的设计是合理的”。另外,这些病毒载量不是来源于高级别病变组织,而是来自于高级别病变周边的低级别病变细胞[7]。
关于HPV定量的争议,具体可以参考《拨云见日 -- HPV 定量,临床价值?科研价值?》 https://mp.weixin.qq.com/s/0Ep4Y0s0Xd-FmgV0YzG3Vw
参考文献:
[1] 《定量检测体外诊断试剂分析性能评估注册审查指导原则》(2022年第32号)
[2] 《定性检测体外诊断试剂分析性能评估注册审查指导原则》(2022年第36号)
[3] Rao A, Young S, Erlich H, Boyle S, Krevolin M, Sun R, Apple R, Behrens C. Development and characterization of the cobas human papillomavirus test. J Clin Microbiol. 2013 May;51(5):1478-84.
[4] FDA Executive Summary 《New Approaches in the Evaluation for High-Risk Human Papillomavirus Nucleic Acid Detection Devices》(March 8 2019 Meeting)
[5] McBride AA, Warburton A. The role of integration in oncogenic progression of HPV-associated cancers. PLoS Pathog. 2017 Apr 6;13(4):e1006211.
[6] Zhong F, Yu T, Ma X, Wang S, Cong Q, Tao X. Extensive HPV Genotyping Reveals High Association between Multiple Infections and Cervical Lesions in Chinese Women. Dis Markers. 2022 Jun 10;2022:8130373.
[7] Fu Xi L, Schiffman M, et al. Type-dependent association between risk of cervical intraepithelial neoplasia and viral load of oncogenic human papillomavirus types other than types 16 and 18. Int J Cancer. 2017 Apr 15;140(8):1747-1756.
声明:本文仅供医疗卫生专业人士为了解资讯使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解资讯以外的目的,平台及作者不承担相关责任。






 2020
2020 