WHO提倡的宫颈癌预防策略包括HPV疫苗接种联合基于HPV检测的筛查,评估CIN3+的风险,并对癌前病变和宫颈癌患者进行规范管理。
流行病学研究报告显示,大约5%的子宫颈癌与HPV持续感染无关。早在2009年Zur Hausen就指出,尽管95%以上的子宫颈癌活检组织中存在hr-HPV基因组,但未必意味着所有宫颈癌均由hr-HPV感染所致。一项共纳入229项研究、共计40,679例子宫颈癌的meta分析显示,10.6%(8.4-13.9%)的患者为hr-HPV阴性。
WHO已经意识到部分子宫颈癌尤其是子宫颈腺癌与HPV感染无关,为此在《2020年WHO女性生殖器肿瘤分类(第5版)》中将子宫颈鳞癌/腺癌再细分为HPV相关性和HPV非相关性子宫颈癌,其中HPV相关性子宫颈腺癌包括:(1)普通型:绒毛腺管变异型;(2)粘液型:粘液型、粘液性非特殊(NOS)腺癌、肠腺癌、印戒细胞腺癌和层状性粘液性腺癌。HPV非相关性子宫颈腺癌包括:(1)胃型腺癌;(2)透明细胞腺癌;(3)中肾腺癌;(4)子宫内膜样腺癌。
那么,HPV阴性宫颈癌的原因是什么呢?
HPV阴性可能与以下因素有关:
(1)HPV非相关性肿瘤(真阴性),如某些腺癌和少数鳞癌亚型;
(2)整合过程中HPV基因组丢失;
(3)分子检测未包括的病毒基因类型;
(4)所使用的诊断方法未能检测到;
(5)误诊为原发性子宫颈癌(转移或原发性子宫体肿瘤)。
HPV非相关性宫颈癌的发生机制尚不明确,流行观点以“打击和病毒逃逸”理论(Hit and Run Viral Theory)解释HPV非相关性宫颈癌的病毒基因组缺失。“打击和病毒逃逸”理论认为,一旦病毒感染引起足够的细胞突变,肿瘤的发生发展就不再依赖于病毒蛋白的表达或感染,肿瘤进展过程中表现为病毒的“丢失”。
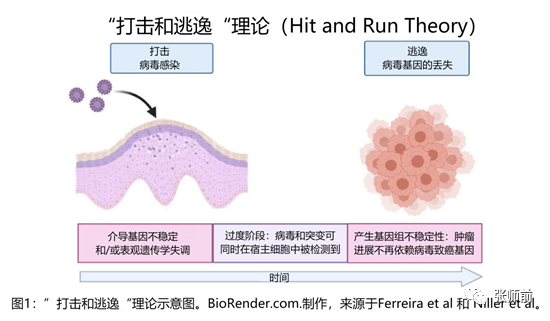
证据表明E6/E7致癌基因启动致癌过程,随着时间的推移和突变的积累,病毒基因的转录不再是必要条件。有研究提出,“打击和病毒逃逸”致癌理论也可通过表观遗传失调产生永久性改变。致癌基因整合、染色质重塑进而影响转录调节、DNA修复和感染细胞的永久性表观遗传学改变,如E7 HR-HPV肿瘤蛋白激活DNA甲基转移酶1(Dnmt1)的活性。在“打击和病毒逃逸”的过程中,病毒基因组在肿瘤浸润前阶段短暂存在,浸润前期病变HPV的持续感染可能是HPV非相关性宫颈癌在病毒“逃逸(Run)”之前所必须的“打击(Hit)”过程。最近有研究对3个HPV非相关性宫颈癌浸润前病灶进行分析,发现其中2个样本显示弥漫性P16ink4a阳性,提示与HPV相关性病变的模式相似,标本中未检测到RB基因或编码p16ink4a蛋白的CDKN2A基因的体系或胚系突变,该研究支持“打击和病毒逃逸”理论。
因此就目前的证据而言,还不能完全排除存在HPV“真”阴性的宫颈癌。未来需要更多的相关研究用以支持HPV非相关性宫颈癌的真实性,甚至评估HPV阴性宫颈癌相关治疗的总体应答率,探索新的生物标记物,以期寻找到更为准确的评价体系。






 2020
2020 