高危型HPV检测作为初筛
为加速消除子宫颈癌,世界卫生组织(WHO)提出2030年全球70%的成年女性至少在35岁和45岁接受两次高质量子宫颈癌筛查的目标。作为人口大国,我国宫颈癌筛查目标人群基数庞大,公共卫生服务体系面临巨大压力,若能从检测技术方法学上取得突破,将极大地缓解这一难题。
在“第四届国际HPV知晓日”中国站活动现场,中国医学科学院北京协和医院妇产科陈飞教授分享了由北京协和医院郎景和院士和国家癌症中心乔友林教授领衔的一项中国多中心、大样本、随机对照临床研究。该研究旨在评估现有基层医疗机构服务能力下,与目前广泛应用的初筛技术相比,在国家子宫颈癌筛查计划中引入HPV检测进行筛查的临床有效性、成本效益及项目绩效。该研究结果已于2020年12月30日在JAMA Oncology在线发表【1】。
陈飞教授表示:“在我国,子宫颈癌的发病率及死亡率仍呈逐年攀升态势。而子宫颈癌是病因明确、早期发现可治愈的恶性肿瘤。有效的筛查方法及预防计划就能减少子宫颈癌的发生风险,使消除子宫颈癌成为可能。本研究是国内首次以人群为基础的多中心、大样本、随机对照子宫颈癌筛查研究,结果显示,将高危型HPV检测作为初筛具有较好的筛查效果与成本效益,是适合我国国情的子宫颈癌筛查更优选择。”
高危型HPV检测CIN2+检出率是传统方法的2倍
该研究从国家“两癌”筛查项目点中选择11个农村和9个城市筛查项目点,每个项目点邀请3,000名年龄35-64岁的女性参与研究,共纳入60,732 名女性。根据经济水平和服务能力的不同,在农村地区采用基于杂交捕获原理的快速HPV检测技术(careHPV),城市地区采用基于PCR原理的HPV分型检测技术(如cobas? 4800 HPV等),与细胞学和醋酸/碘染色肉眼观察法(VIA/VILI)的筛查效果进行同期比较,主要临床观察指标为高级别宫颈病变CIN2+和CIN3+检出率,次要指标为阴道镜转诊率。
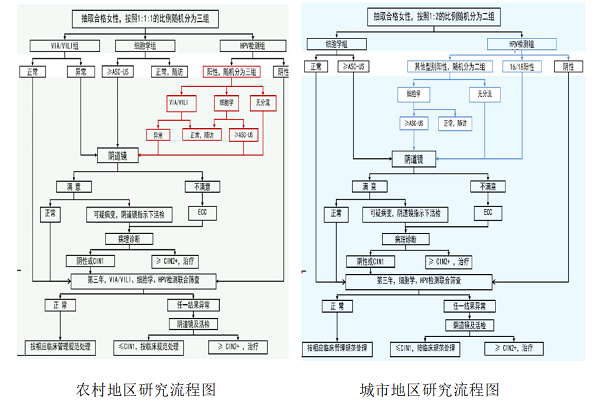
陈飞教授介绍,子宫颈癌筛查传统采用细胞学和VIA/VILI,是依赖于形态学的主观检测方法,漏诊率及假阳性率较高,且需要大量的细胞学医生进行诊断,作为大规模筛查有一定的局限性。高危型HPV检测现已被证实是筛查子宫颈癌的有效方法【2-5】。国外开展的大型前瞻性临床试验结果显示,基于HPV检测技术的筛查方法有效性明显高于细胞学检查【6】。
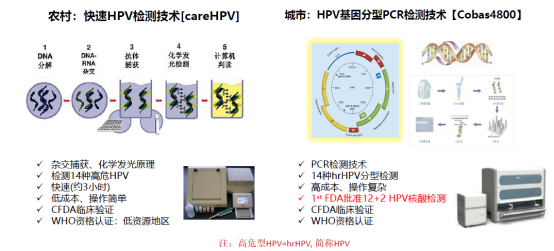
研究显示,高危型HPV检测作为初筛方法,CIN2+和CIN3+检出率是细胞学或VIA/VILI的2.0-2.7倍,且HPV阳性细胞学分流组相比细胞学组大幅降低了阴道镜转诊率。24个月随访时,细胞学阴性或VIA/VILI阴性女性患CIN2+的风险是HPV阴性的2-4倍。研究证实了相比于现行的细胞学和VIA/VILI,高危型HPV检测作为初筛方法用于大规模的子宫颈癌人群筛查具有提高检出率、降低漏诊率的显著优势。
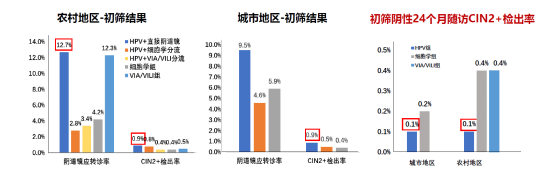
高危型HPV检测作为初筛方法成本效益更高
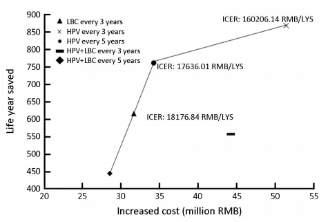
基于该项目筛查人群,研究团队同时进行了卫生经济学评价,收集了卫生经济学和流行病学参数,将现场调查获得的人群筛查、诊断、治疗的相关临床资料和成本数据代入模型,模拟中国妇女在采用不同筛查方案干预后子宫颈癌的发生、发展,并预测其筛查效果[包括累积发病率、累积发病风险、挽救的生命年和质量调整生命年(QALY)、收益]和相应的成本费用,进行了成本效果分析、成本效用分析、成本效益分析。
评估结果显示,基于杂交捕获原理的careHPV检测每3年或5年一次的筛查方案在中国农村地区值得推荐;基于PCR原理的HPV分型检测(如cobas?4800 HPV等)每5年一次、液基细胞学检查(LBC)每3年一次是非常具有成本效果的筛查方案,推荐在中国城市地区施行。
对于参与本研究的城乡基层医疗机构,符合要求的医务人员比例均是HPV检测高于细胞学检查,且HPV检测所用的人员数量和时间均少于细胞学检查,HPV检测效率更高,表明HPV作为子宫颈癌初筛方案更适合基层医疗机构现有的服务能力。
“本研究具体实施依靠‘两癌’筛查项目点的基层技术力量、基础设施等资源,具有极强的现实意义,为我国及发展中国家建立与实施持续可行的筛查方案提供了循证医学证据。”陈飞教授指出,“将HPV检测技术引入临床是子宫颈癌筛查和早诊史上的里程碑,实现了从细胞形态学向分子生物学的变革,改变了60多年的临床实践,并为解决全国上亿适龄女性的子宫颈癌筛查难题迈出了关键一步。”
作为本届“国际HPV知晓日”的支持方,罗氏诊断始终高度关注女性健康,致力于研发、优化覆盖育龄期、孕产期、乃至围绝经期不同阶段女性健康的整体解决方案。其中,cobas?HPV基因检测、CINtec?PLUS全自动细胞学检测和CINtec?组织学检测系统为宫颈癌筛查提供完整、多元化的“筛查-分流-诊断”方案选择,满足不同医疗服务系统的实际需求。
参考文献
1.Zhang JJ, Zhao YQ, Dai Y, Dang L…QiaoYL, Lang JH, et.al. Effectiveness of High-risk Human Papillomavirus Testing for Cervical Cancer Screening in China: A Multicenter, Open-Label, Randomized Clinical Trial. JAMA Oncology. 2021, 7(2):263-270.
2.Bulkmans NW, Berkhof J, Rozendaal L, et al. Human papillomavirus DNA testing for the detection of cervical intraepithelial neoplasia grade 3 and cancer: 5-year follow-up of a randomized controlled implementation trial. Lancet. 2007;370 (9601):1764-1772.
3.Ogilvie GS, van Niekerk D, Krajden M, et al. Effect of screening with primary cervical HPV testing vs cytology testing on high-grade cervical intraepithelial neoplasia at 48 months: the HPV FOCAL randomized clinical trial. JAMA. 2018;320 (1):43-52.
4.Dijkstra MG, van Zummeren M, Rozendaal L, et al. Safety of extending screening intervals beyond five years in cervical screening programmes with testing for high risk human papillomavirus: 14 year follow-up of population based randomized cohort in the Netherlands. BMJ. 2016;355:i4924.
5.Anttila A, Kotaniemi-Talonen L, Leinonen M, et al. Rate of cervical cancer, severe intraepithelial neoplasia, and adenocarcinoma in situ in primary HPV DNA screening with cytology triage: randomised study within organised screening programme. BMJ. 2010;340:c1804.
6.Ronco G, Dillner J, Elfstr?m KM, et al; International HPV screening working group. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet. 2014;383 (9916):524-532.






 2020
2020 